INSULINA
La insulina (/ˈɪn.sjʊ.lɪn/, del latín insula, «isla») es una hormona peptídica producida por las células beta de los islotes pancreáticos; se considera que es la principal hormona anabólica del cuerpo. Regula el metabolismo de los carbohidratos, las grasas y las proteínas al promover la absorción de glucosa de la sangre al hígado, la grasa y las células del músculo esquelético. En estos tejidos, la glucosa absorbida se convierte en glucógeno mediante glucogénesis o grasas (triglicéridos) mediante lipogénesis o, en el caso del hígado, en ambos.
La producción y secreción de glucosa por el hígado se inhibe fuertemente por las altas concentraciones de insulina en la sangre. La insulina circulante también afecta la síntesis de proteínas en una amplia variedad de tejidos. Por lo tanto, es una hormona anabólica que promueve la conversión de pequeñas moléculas en la sangre en grandes moléculas dentro de las células. Los niveles bajos de insulina en la sangre tienen el efecto contrario al promover un catabolismo generalizado, especialmente de la grasa corporal de reserva.
Las células beta son sensibles a los niveles de azúcar en sangre, por lo que secretan insulina a la sangre en respuesta a un nivel alto de glucosa e inhiben la secreción de insulina cuando los niveles de glucosa son bajos. La insulina mejora la absorción y el metabolismo de la glucosa en las células, reduciendo así los niveles de azúcar en sangre.
Sus células alfa vecinas, al seguir las señales de las células beta, secretan glucagón en la sangre de manera opuesta: mayor secreción cuando la glucosa en sangre es baja y menor secreción cuando las concentraciones de glucosa son altas. El glucagón aumenta los niveles de glucosa en sangre al estimular la glucogenólisis y la gluconeogénesis en el hígado. La secreción de insulina y glucagón en la sangre en respuesta a la concentración de glucosa en sangre es el mecanismo principal de la homeostasis de la glucosa.
La disminución o pérdida de la actividad de la insulina resulta en diabetes mellitus, una condición de alto nivel de azúcar en sangre (hiperglucemia). Hay dos tipos de enfermedades. En la diabetes mellitus tipo 1, las células beta son destruidas por una reacción autoinmune, de modo que la insulina ya no puede sintetizarse o secretarse a la sangre.En la diabetes mellitus tipo 2, la destrucción de las células beta es menos pronunciada que en la diabetes tipo 1, y no se debe a un proceso autoinmune.
En cambio, hay una acumulación de amiloide en los islotes pancreáticos, lo que probablemente altera su anatomía y fisiología. La patogenia de la diabetes tipo 2 no se comprende bien, pero se sabe que está involucrada la reducción de la población de células beta de los islotes, la función secretora reducida de las células beta de los islotes que sobreviven y la resistencia a la insulina de los tejidos periféricos. La diabetes tipo 2 se caracteriza por una mayor secreción de glucagón que no se ve afectada ni responde a la concentración de glucosa en sangre. Pero la insulina todavía se secreta en la sangre en respuesta a la glucosa en sangre. Como resultado, la glucosa se acumula en la sangre.
La proteína de la insulina humana está compuesta por 51 aminoácidos y tiene una masa molecular de 5808 Da. Es un heterodímero de cadena A y cadena B, que están unidos por enlaces disulfuro. La estructura de la insulina varía ligeramente entre especies de animales. La insulina de origen animal difiere un poco en eficacia (en los efectos del metabolismo de los carbohidratos) de la insulina humana debido a estas variaciones.
La insulina porcina está especialmente cerca de la versión humana y se usó ampliamente para tratar a los diabéticos tipo 1 antes de que la insulina humana pudiera producirse en grandes cantidades mediante tecnologías de ADN recombinante.
La insulina fue la primera hormona peptídica descubierta. Frederick Banting y Charles Herbert Best, trabajando en el laboratorio de J.J.R. Macleod, de la Universidad de Toronto, fue el primero en aislar la insulina del páncreas del perro en 1921. Frederick Sanger secuenció la estructura de aminoácidos en 1951, lo que convirtió a la insulina en la primera proteína en secuenciarse completamente.

La estructura cristalina de la insulina en estado sólido fue determinada por Dorothy Hodgkin en 1969. La insulina es también la primera proteína que se sintetiza químicamente y se produce mediante tecnología de ADN recombinante. Está en la Lista Modelo de Medicamentos Esenciales de la OMS, los medicamentos más importantes necesarios en un sistema de salud básico.
Gene
El precursor de la insulina, la preproinsulina, está codificado por el gen INS, que se encuentra en el cromosoma 11p15.5.
Alelos
Se han identificado una variedad de alelos mutantes con cambios en la región codificante. Un gen de lectura completa, INS-IGF2, se superpone con este gen en la región 5 ‘y con el gen IGF2 en la región 3’.
Estructura
Ver también: Familia de la insulina / IGF / Relaxina e Insulina y su estructura análoga
La estructura de la insulina. El lado izquierdo es un modelo de llenado de espacio del monómero de insulina, que se cree que es biológicamente activo. El carbono es verde, blanco hidrógeno, rojo oxígeno y azul nitrógeno. En el lado derecho hay un diagrama de cinta del hexámero de insulina, que se cree que es la forma almacenada. Una unidad de monómero se resalta con la cadena A en azul y la cadena B en cian. El amarillo denota enlaces disulfuro y las esferas magenta son iones de zinc.
Contrariamente a la creencia inicial de que las hormonas serían generalmente moléculas químicas pequeñas, como la primera hormona peptídica conocida de su estructura, se descubrió que la insulina era bastante grande. Una sola proteína (monómero) de la insulina humana está compuesta por 51 aminoácidos y tiene una masa molecular de 5808 Da.
La fórmula molecular de la insulina humana es C257H383N65O77S6. Es una combinación de dos cadenas peptídicas (dímero) llamadas cadena A y cadena B, que están unidas por dos enlaces disulfuro. La cadena A se compone de 21 aminoácidos, mientras que la cadena B consta de 30 residuos. Los enlaces disulfuro de enlace (intercadena) se forman en los residuos de cisteína entre las posiciones A7-B7 y A20-B19.
Hay un enlace disulfuro adicional (intracadena) dentro de la cadena A entre los residuos de cisteína en las posiciones A4 y A11. La cadena A exhibe dos regiones α-helicoidales en A1-A8 y A12-A19 que son antiparalelas; mientras que la cadena B tiene una hélice α central (que cubre los residuos B9-B19) flanqueada por el enlace disulfuro a cada lado y dos láminas β (que cubren B7-B10 y B20-B23).
La secuencia de aminoácidos de la insulina está fuertemente conservada y varía solo ligeramente entre especies. La insulina bovina se diferencia de la humana en solo tres residuos de aminoácidos y la insulina porcina en uno. Incluso la insulina de algunas especies de peces es lo suficientemente similar a la de los humanos como para ser clínicamente efectiva en los humanos. La insulina en algunos invertebrados es bastante similar en secuencia a la insulina humana y tiene efectos fisiológicos similares
La fuerte homología observada en la secuencia de insulina de diversas especies sugiere que se ha conservado a lo largo de gran parte de la historia evolutiva de los animales. El péptido C de la proinsulina, sin embargo, difiere mucho más entre especies; también es una hormona, pero secundaria.
La insulina se produce y se almacena en el cuerpo como un hexámero (una unidad de seis moléculas de insulina), mientras que la forma activa es el monómero.
Síntesis
La insulina se produce en el páncreas y el cuerpo de Brockmann (en algunos peces) y se libera cuando se detecta alguno de varios estímulos. Estos estímulos incluyen el aumento de las concentraciones plasmáticas de aminoácidos y glucosa resultante de la digestión de los alimentos.
Los carbohidratos pueden ser polímeros de azúcares simples o los propios azúcares simples. Si los carbohidratos incluyen glucosa, esa glucosa se absorberá en el torrente sanguíneo y el nivel de glucosa en sangre comenzará a aumentar.
En las células diana, la insulina inicia la transducción de señales, que tiene el efecto de aumentar la absorción y el almacenamiento de glucosa. Finalmente, la insulina se degrada, poniendo fin a la respuesta.
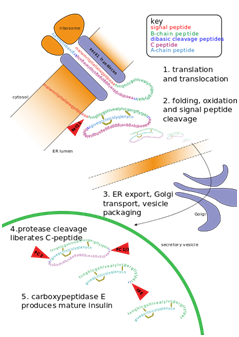
La insulina consta de dos cadenas polipeptídicas, las cadenas A y B, unidas entre sí por enlaces disulfuro. Sin embargo, primero se sintetiza como un único polipéptido llamado preproinsulina en las células beta. La preproinsulina contiene un péptido señal de 24 residuos que dirige la cadena polipeptídica naciente al retículo endoplásmico rugoso (RER). El péptido señal se escinde cuando el polipéptido se transloca al lumen del RER, formando proinsulina. En el RER, la proinsulina se pliega en la conformación correcta y se forman 3 enlaces disulfuro. Aproximadamente 5 a 10 min después de su ensamblaje en el retículo endoplásmico, la proinsulina se transporta a la red trans-Golgi (TGN) donde se forman los gránulos inmaduros. El transporte al TGN puede tardar unos 30 minutos.
La proinsulina madura en insulina activa a través de la acción de endopeptidasas celulares conocidas como convertasas prohormona (PC1 y PC2), así como la exoproteasa carboxipeptidasa E. Las endopeptidasas se escinden en 2 posiciones, liberando un fragmento llamado péptido C y dejando 2 péptidos. cadenas, las cadenas B y A, unidas por 2 enlaces disulfuro.
Los sitios de escisión están ubicados cada uno después de un par de residuos básicos (lisina-64 y arginina-65, y arginina-31 y -32). Después de la escisión del péptido C, estos 2 pares de residuos básicos son eliminados por la carboxipeptidasa. El péptido C es la porción central de la proinsulina, y la secuencia primaria de la proinsulina va en el orden «B-C-A» (las cadenas B y A se identificaron sobre la base de la masa y el péptido C se descubrió más tarde).
La insulina madura resultante se empaqueta dentro de gránulos maduros esperando que las señales metabólicas (como leucina, arginina, glucosa y manosa) y la estimulación del nervio vago sean exocitadas de la célula a la circulación.
La producción endógena de insulina se regula en varios pasos a lo largo de la vía de síntesis:
- Una transcripción del gen de la insulina.
- En estabilidad de ARNm
- En la traducción del ARNm
- En las modificaciones postraduccionales
Se ha demostrado que la insulina y sus proteínas relacionadas se producen dentro del cerebro, y los niveles reducidos de estas proteínas están relacionados con la enfermedad de Alzheimer.
La liberación de insulina también es estimulada por la estimulación del receptor beta-2 e inhibida por la estimulación del receptor alfa-1. Además, el cortisol, el glucagón y la hormona del crecimiento antagonizan las acciones de la insulina en momentos de estrés. La insulina también inhibe la liberación de ácidos grasos por la lipasa sensible a hormonas en el tejido adiposo.
Liberación
Ver también: regulación de la glucosa en sangre
Las células beta de los islotes de Langerhans liberan insulina en dos fases. La liberación de la primera fase se activa rápidamente en respuesta al aumento de los niveles de glucosa en sangre y dura aproximadamente 10 minutos.
La segunda fase es una liberación lenta y sostenida de vesículas recién formadas que se desencadena independientemente del azúcar y alcanza su punto máximo en 2 a 3 horas. La liberación reducida de insulina en la primera fase puede ser el defecto detectable más temprano de las células beta que predice la aparición de la diabetes tipo 2. La liberación de primera fase y la sensibilidad a la insulina son predictores independientes de diabetes.